人们翘首以盼的新冠肺炎疫苗,有了最新进展。
据美联社报道,3月16日,第一批临床试验志愿者在美国西雅图接受注射。该疫苗项目的发起者是美国国立卫生研究院(NIH)和美国生物科技公司Moderna;前者同时是项目资助方。
人体试验的开始,意味着距离疫苗上市又近了一步,但总耗时仍将远超公众的期望。“至少还需要一年”才能问世,这是世界卫生组织总干事谭德塞给出的乐观估计。
虽然大家都希望疫情尽快结束,但疫情的离开却也可能终结疫苗的研发。毕竟,2003年SARS疫苗就是这样“胎死腹中”的。
北京科兴生物制品有限公司曾参与研发SARS疫苗,并于2004年12月5日完成了共36名受试者的一期临床试验。然而,早在2003年7月,此次非典疫情就基本结束,已经没有患者可供试验,因此疫苗的二期临床试验不得不就此终止。“科兴不仅颗粒无收,且为此停掉了成品疫苗生产线,出现了持续亏损,”《财经》杂志写道。
技术问题的攻克至关重要,但决定一支疫苗能否成功上市的因素,比我们预想的要复杂。
一般情况下,疫苗从研发到上市至少8年
科兴的一期临床试验一共花费了8个月,虽然没追上非典疫情,但相对于普通疫苗的研发速度来说,已经算快的了。据国家药监局科普,“通常,一个疫苗从研发到上市,至少要经过8年甚至20多年漫长的研发历程。”

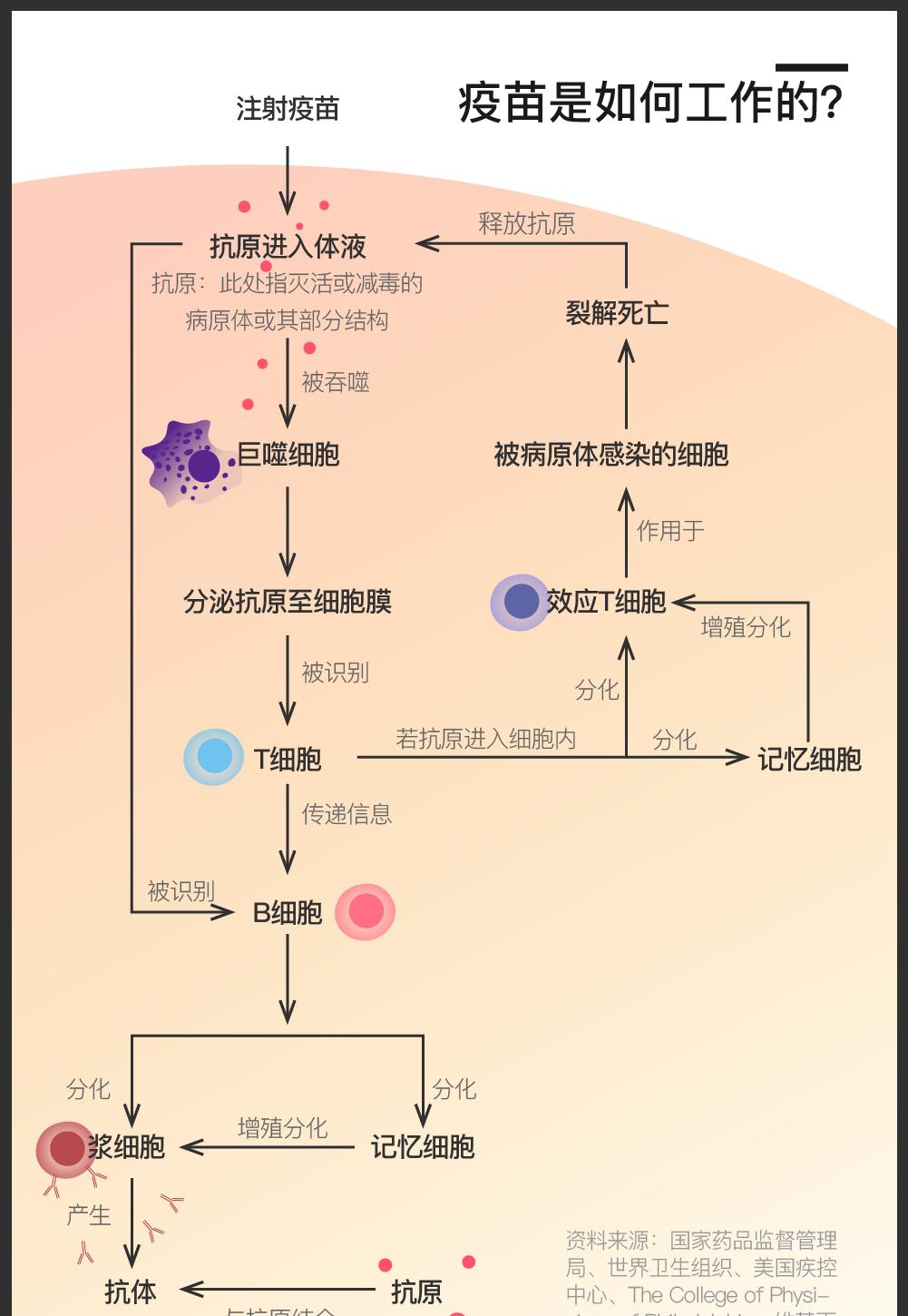
上图展示了一支普通疫苗的研发流程。如图所示,非典时期北京科兴完成的一期临床试验,是最初步的人体试验,用于探索人体对疫苗的耐受程度。这之后的二期和三期试验,则重点探索疫苗的剂量及安全性。其中,三期临床试验结果是疫苗注册获批的基础,因为它是一个随机、多地、大量、双盲的试验。
这三期临床试验做下来,一般要3到8年,有的甚至长达10年以上。
在我国,加快疫苗上市的一个办法,是通过国家出台的相关政策,申请缩短审批时间,比如优先审批通道、特殊审批等等。丁香园Insight数据库负责人赵仲告诉澎湃新闻,目前临床试验申请实行默认许可制,一般60个工作日内可出结果。但疫情期间,机构可向国家药监局药品审评中心申请加速。
另外,疫苗的注册审批也可通过优先审批或特殊审批通道加速获批。2019年国家药监局审批疫苗的时间大概要2年左右,但17年注册成功的埃博拉疫苗,借由相关政策,产品报上市的审评审批时间不到200天。
但临床试验的时间是很难被大量压缩的。筛选合适的病人入组需要时间,观察病人对疫苗的免疫反应也需要时间。“这些都是必要的时间,所以现在说一年内就能上市的疫苗,通常来讲是不严谨的。”赵仲解释道。
这是由疫苗的运作原理决定的。简单地说,疫苗是通过将灭活或减毒的病原体或其部分结构注入人或动物体内,唤醒免疫细胞辨认、记忆抗原并生成相应的抗体,来使人或动物收获对某种疾病的免疫力的。其效用依赖于被注入机体后所诱发的免疫应答,因而研发及临床试验的各个环节都充满了未知。而如果想要打造一款在安全性、免疫反应强度、免疫持续期、时间及经济成本等方面均表现出色的疫苗,耗时长更是必然的。
以往对SARS和MERS的研究,加速这次疫苗研发
世界卫生组织已将新冠肺炎定性为“全球大流行”。无人能预估疫情将于何时终结。疫苗的研发因而变成了一场与时间的赛跑。
此次疫苗研发已经创下了历史速度。3月16日,据美联社消息,一位政府官员透露,第一批志愿者开始接种Moderna研制的新冠肺炎候选疫苗,意味着新冠疫苗的临床试验正式启动。另外还有3家研发团队预计将于4月进入临床试验。

这次候选疫苗的研发之所以能这么快,除了疫情的形势所迫,还因为“我们已经为研究其他冠状病毒的疫苗投入了很多资源”,流行病预防创新联盟(CEPI)首席执行官Richard Hatchett接受卫报采访时解释道。距离最近的两次冠状病毒疫情分别是2003年的SARS和2012年的MERS。
目前疫苗研发速度最快的美国生物科技公司Moderna,据《麻省理工科技评论》报道,在整个候选疫苗的研发中,他们甚至不用新冠病毒的实际样本,只需要网络公共数据库中的基因组序列就可以开始工作。Moderna已经用这种方法研发过一些候选疫苗,包括流感病毒,这次他们只需要针对新病毒稍作调整即可。
Moderna此次研发的mRNA疫苗(核酸疫苗)是目前新冠疫苗备选的类型之一,也是最受关注的一种。这种疫苗只是选择了病毒中刺激人体免疫力的一小部分基因,把它作为有效成分送进人体。
斯微生物CEO李航文接受新京报采访时提到:“核酸疫苗相当于直接在外卖APP上点单吃饭,而灭活、减毒疫苗则相当于要从买菜开始一步步做起。”

但候选疫苗和上市疫苗终究是不一样的。前者的快速问世压缩的是疫苗研发第一阶段——临床前研究——的投入时间,而之后的三期临床试验,是不可能被这么压缩的。
美国国立卫生研究院过敏及传染性疾病研究所所长安东尼·福西在美参议院的听证会上明确表示,候选疫苗可以在两个月甚至是六周内进入一期临床试验,但这不是疫苗,因为还需要三个月及以上的时间去验证它的安全性,之后再继续二期试验。
因此,特朗普要求几个月内上市新冠疫苗的愿望,基本是不可能实现的。《华盛顿邮报》写道:新冠疫苗的正式上市最快也需要一年时间。
公司宣布研发也会获益,美企股价上涨174%
对于药企来说,特大疫情下的疫苗研发也许是一次商机。据新华网报道,非典期间,如果成熟的药品拿到新药证书,会有几千万甚至是上亿的转让费;当疫苗成果转化为企业产品后,市场价值还将扩大100倍。
即便是宣布参与疫苗研发的当下,也可能产生收益。新浪财经报道称,1月21日,重庆智飞生物借着“新冠疫苗”概念股的热潮,市值首次突破了千亿元,成为A股市场中第6只市值破千亿元的医药股。
MarketWatch也曾报道,2月28日,因有消息指出美国生物制药公司iBio将与北京睿诚海汇达成合作,以植物为基础的技术研发新冠疫苗,2月28日当天前者的股价即上涨174%,当周股价累计上涨689%。领英显示,该公司的规模在11到50人之间。
另一家生物制药公司Applied DNA Sciences,在宣布完成4种候选疫苗的设计后,3月2日当天股价上涨70%。领英显示,这家公司的全职员工不到200名。
但新冠疫苗研发的动向,对大公司的影响可能没那么明显。2月3日,美国制药巨头葛兰素史克(GSK)宣布与CEPI达成合作,致力于帮助全球企业研发新冠疫苗,当日股价下跌了0.4%,此后一直在缓缓下降。24日,这家公司宣布与四川三叶草生物制药达成技术合作,当天股价又下降了1.8%。
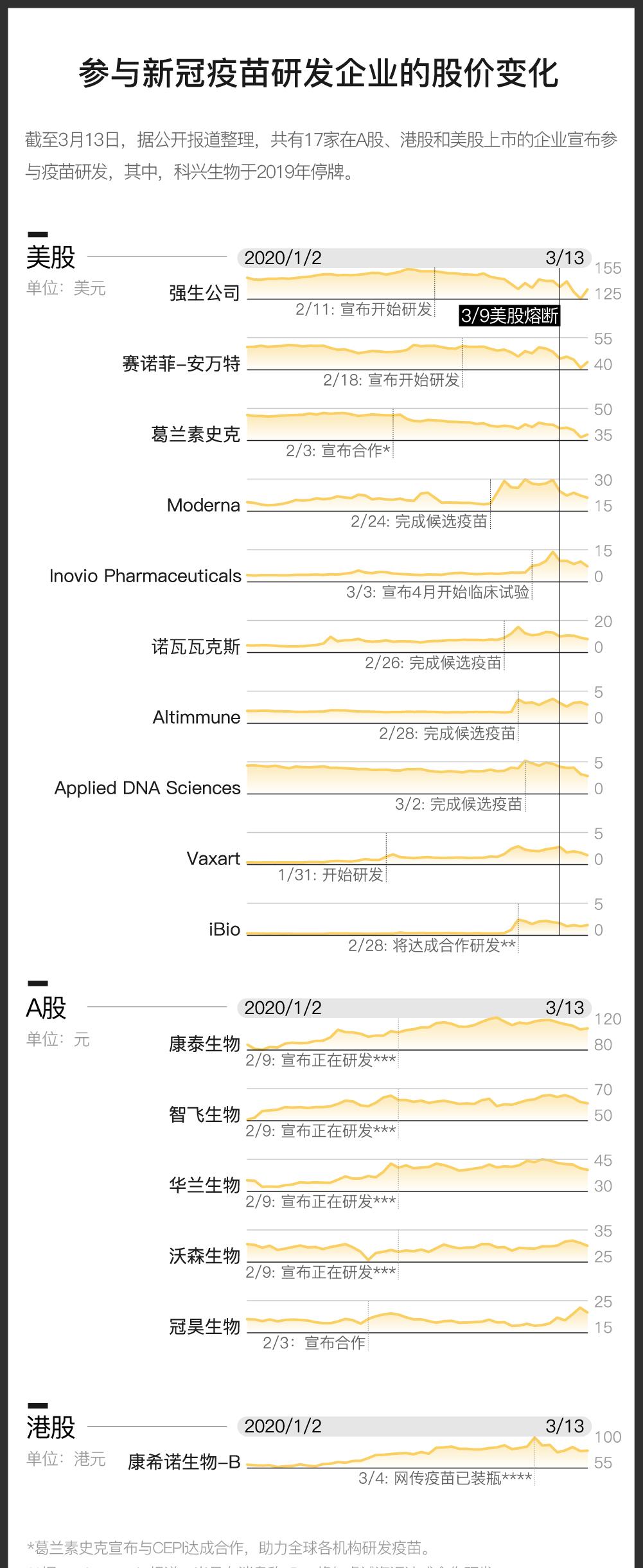
据华尔街日报报道,3月10日当天,美股生物制药股份都出现了不同程度的下跌。分析师指出,这可能是因为投资者们担心新冠疫苗和药物研发的时间过长所致,有些研究需要花费好几年,到时候新冠病毒可能早已结束。
疫苗或许会晚到,但疫情也可能再来
投资者们的担心并非没有道理,急性传染病疫情的爆发终究是不稳定的。如开头所说,一旦结束,没有患者可供临床试验,政府和药企也失去了动力继续投资。
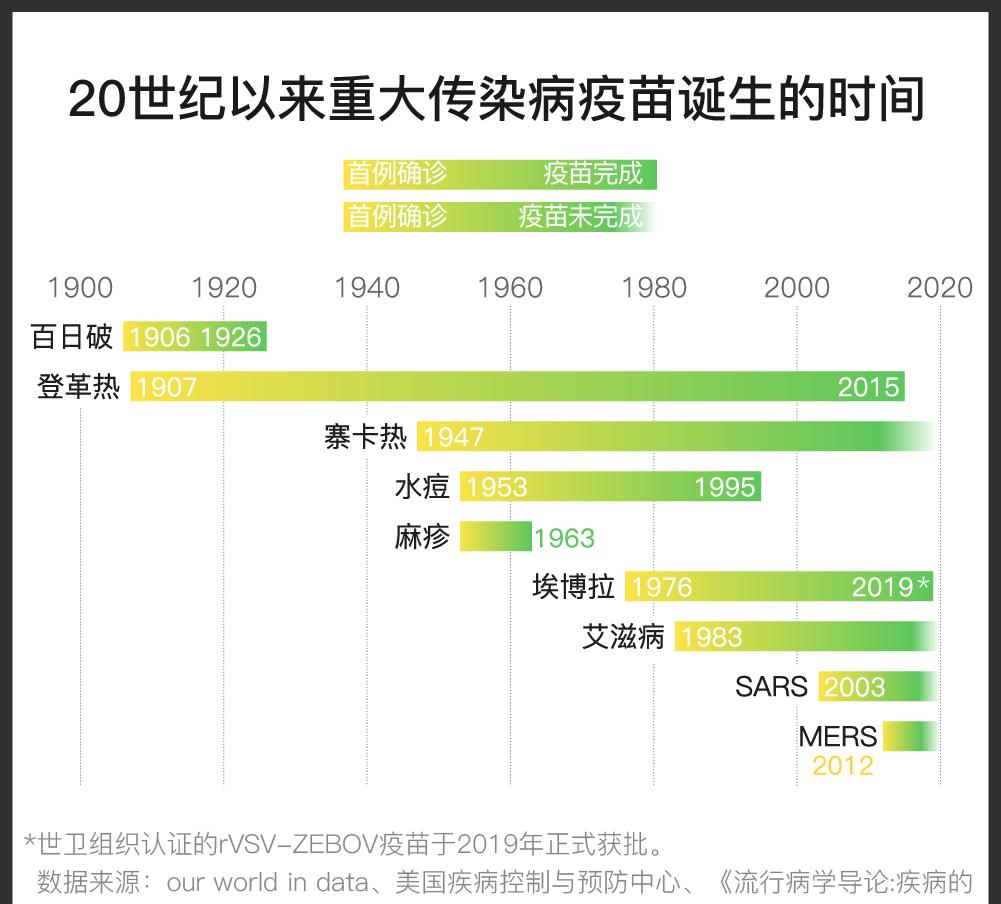
1976年出现的埃博拉正是因此迟迟等不到疫苗。
据美国媒体STAT报道,加拿大国家微生物学实验室多年来一直在研发埃博拉疫苗,而且它在动物药效试验中已经表现得很好,但因为疫情总是零零散散地发生着,他们始终无法进行大规模的人体临床试验;也没有大型药企愿意参与研发。
2014年4月,埃博拉病毒开始在西非大规模爆发,这一切才迎来转机。当年8月,世卫组织宣布此次疫情为全球公共卫生紧急事件。11月,默克和NewLink(实验室的合作药企)达成协议,从后者手中接手埃博拉疫苗,开始临床试验。2015年8月,《柳叶刀》发表了试验结果,在不到12个月的时间里,研究人员就完成了12项临床试验,从首次人体试验一直到三期临床试验。
直到2019年11月11日,名为Ervebo的疫苗终于获得了欧盟委员会的批准。11月12日,WHO批准了这款疫苗的“预认证”。12月21日,美国食药监局(FDA)也批准通过。FDA资料显示,只要在暴露10天前注射,这款疫苗的有效率即可达到100%。
但如果新冠肺炎演变为慢性病或季节性流行病,或者冠状病毒在未来再次引发新型疾病,研发疫苗的价值就会显现。
“我们不能指望(新冠肺炎)会像流感一样会消失在夏天”,世卫组织突发卫生事件规划执行主任Mike Ryan在3月6日的一场发布会上提到。“所以我们得斗争,而不是干等着病毒自己消失。”
疫苗和免疫规划专家陶黎纳在接受新京报采访时也表示,2003年暴发的SARS、2012年暴发的MERS,加上今年的新冠肺炎,“21世纪以来,就已经出现了3种大规模感染人类的冠状病毒。三连击之后,我们才意识到将来说不定还有第四种,才下定决心研发针对冠状病毒的疫苗。”
疫苗临床试验需要多久才能上市(疫苗进入临床试验后多长时间能上市)
编辑:众学网